Введите слово или словосочетание на любом языке 👆
Язык:
Перевод и анализ слов искусственным интеллектом ChatGPT
На этой странице Вы можете получить подробный анализ слова или словосочетания, произведенный с помощью лучшей на сегодняшний день технологии искусственного интеллекта:
- как употребляется слово
- частота употребления
- используется оно чаще в устной или письменной речи
- варианты перевода слова
- примеры употребления (несколько фраз с переводом)
- этимология
Что (кто) такое Торий - определение
ХИМИЧЕСКИЙ ЭЛЕМЕНТ
Найдено результатов: 171
ТОРИЙ
(лат. Thorium), Th, химический элемент III группы периодической системы, атомный номер 90, атомная масса 232,0381, относится к актиноидам. Радиоактивен, наиболее устойчивый изотоп 232Th (период полураспада 1,389·1010 лет). Название от имени бога Тора. Серебристо-белый металл; плотность 11,724 г/см3, tпл 1750 °С. Добывают главным образом из монацита. Применяется для легирования сплавов, как геттер при изготовлении электроламп. Перспективное ядерное топливо, в котором 232Th мог бы превращаться в уран 233U. Последний может участвовать в цепной реакции деления. ThO2 - огнеупорный материал.
торий
м.
Химический радиоактивный элемент, серовато-белый, блестящий, относительно мягкий металл.
Химический радиоактивный элемент, серовато-белый, блестящий, относительно мягкий металл.
торий
Торий
I
То́рий
Спурий (Spurius Torius), римский политический деятель, народный трибун 111 до н. э., проведший закон, по которому различные категории государственных земель (ager publicus) переходили в частную собственность, то есть их можно было продавать. Закон Т. завершал постепенную отмену реформ, проведённых Гракхами (См. Гракхи).
II
То́рий (лат. Thorium)
Th, радиоактивный химический элемент, первый член семейства актиноидов (См. Актиноиды), входящих в III группу периодической системы Менделеева; атомный номер 90, атомная масса 232,038; серебристо-белый пластичный металл. Природный Т. практически состоит из одного долгоживущего изотопа 232Th - родоначальника одного из радиоактивных рядов (См. Радиоактивные ряды) - с периодом полураспада T1/2 = 1,39․1010 лет (содержание изотопа 228Th, находящегося с ним в равновесии, ничтожно - 1,37․10-8\%) и четырёх короткоживущих изотопов, два из которых относятся к радиоактивному ряду урана - радия: 234Th (T1/2 = 24,1 сут) и 230Th (T1/2 = 8,0․104 лет), остальные - к ряду актиния: 231Th (T1/2 = 25,6 ч) и 227Th (T1/2 = 18,17 сут). Из искусственно полученных изотопов наиболее устойчив 229Th (T1/2 = 7340 лет).
Т. открыт в 1828 И. Я. Берцелиусом в одном из Сиенитов в Норвегии. Элемент назван по имени бога грома в скандинавской мифологии - Тора, а минерал - силикат тория - Торитом.
Распространение в природе. Т.- характерный элемент верхней части земной коры - гранитного слоя и осадочной оболочки, где его в среднем содержится соответственно 1,8 ·10-3\% и 1,3·10-3\% по массе. Т. сравнительно слабомигрирующий элемент; в основном он участвует в магматических процессах, накапливаясь в гранитах, щелочных породах и пегматитах. Способность к концентрации слабая. Известно 12 собственных минералов Т. (см. Ториевые руды). Т. содержится в Монаците, уранините, цирконе, апатите, ортите и др. (см. Радиоактивные минералы). Основной промышленный источник Т. - монацитовые россыпи (морские и континентальные). В природных водах содержится особенно мало Т.: в пресной воде 2․10-9\%, в морской воде 1․10-9\%. Он очень слабо мигрирует в биосфере и гидротермальных растворах.
Физические и химические свойства. Т. существует в виде двух модификаций: α-формы с гранецентрированной кубической решёткой при температуре до 1400 °С (а = 5,086 Å) и β-формы с объёмноцентрированной кубической решёткой при температуре выше 1400 °С (a = 4,11 Å). Плотность Т. (рентгено-графическая) 11,72 г/см3 (25 °С); атомный диаметр в α-форме 3,59 Å, в β-форме 3,56 Å; ионные радиусы Th3+ 1,08 Å, Th4+ 0,99 Å; tпл 1750 °С; tkип 3500- 4200 °C.
Мольная теплоёмкость Т. 27,32 кдж/(кмоль․К) [6,53 кал/(г-атом․°С)] при 25 °С; теплопроводность при 20 °С 40,19 вт/м․К) [0,096 кал/(см․сек․°С)]; температурный коэффициент линейного расширения 12,5․10-6 (25-100 °С); удельное электросопротивление 13․10-6-18․10-6 ом․см (25 °С); температурный коэффициент электросопротивления 3,6․10-3-4․10-3. Т. парамагнитен; удельная магнитная восприимчивость 0,54․10-6 (20 °С). При 1,4К переходит в состояние сверхпроводимости.
Т. легко деформируется на холоду; механические свойства Т. сильно зависят от его чистоты, поэтому предел прочности при растяжении Т. варьирует от 150 до 290 Мн/м 2 (15-29 кгс/мм 2), твёрдость по Бринеллю от 450 до 700 Мн/м 2 (45-70 кгс/мм 2). Конфигурация внешних электронов атома Th 6d 27s 2.
Хотя Т. относится к семейству актиноидов, однако по некоторым свойствам он близок также к элементам второй подгруппы IV группы периодической системы Менделеева - Ti, Zr, Hf. В большинстве соединений Т. имеет степень окисления +4.
На воздухе при комнатной температуре Т. окисляется незначительно, покрываясь защитной плёнкой чёрного цвета; выше 400 °С быстро окисляется с образованием ThO2 - единственного окисла, который плавится при 3200 °С и обладает высокой химической устойчивостью. Получают ThO2 термическим разложением нитрата, оксалата или гидроокиси Т. С водородом при температурах выше 200 °С Т. реагирует с образованием порошкообразных гидридов ThH2, ThH3 и др. состава. В вакууме при температуре 700-800 °С из Т. можно удалить весь водород. При нагревании в азоте выше 800 °С образуются нитриды ThN и Th2N3, которые разлагаются водой с выделением аммиака. С углеродом образует два карбида - ThC и ThC2; они разлагаются водой с выделением метана и ацетилена. Сульфиды ThS, Th2S3, Th7S12, ThS2 могут быть получены при нагревании металла с парами серы (600-800 °С). Т. реагирует с фтором при комнатной температуре, с остальными галогенами - при нагревании, с образованием галогенидов типа ThX4 (где Х - галоген). Наиболее важное промышленное значение из галогенидов имеют фторид ThF4 и хлорид ThCl4. Фторид получают действием HF на ThO2 при повышенных температурах; хлорид - хлорированием смеси ThO2 с углём при повышенных температурах. Фторид мало растворим в воде и минеральных кислотах; хлорид, бромид и йодид - гигроскопичны и хорошо растворимы в воде. Для всех галогенидов известны кристаллогидраты, выделяемые кристаллизацией из водных растворов.
Компактный Т. при температурах до 100 °С медленно корродирует в воде, покрываясь защитной окисной плёнкой. Выше 200 °С активно реагирует с водой с образованием ThO2 и выделением водорода. Металл на холоду медленно реагирует с азотной, серной и плавиковой кислотами, легко растворяется в соляной кислоте и царской водке. Соли Т. образуются в виде кристаллогидратов. Растворимость солей в воде различна: хорошо растворимы нитраты Th (NO3)4․nH2O; труднорастворимы сульфаты Th (SO4)2․nH2O, основной карбонат ThOCO3․8H2O, фосфаты Th3(PO4)4․4H2O и ThP2O7․2H2O; практически нерастворим в воде оксалат Th (C2O4)2․6H2O. Растворы щелочей слабо действуют на Т. Гидроокись Th (OH)4 осаждается из солей Т. в интервале pH = 3,5-3,6 в виде аморфного осадка. Для ионов Th4+ в водных растворах характерна ярко выраженная способность к образованию комплексных соединений и двойных солей.
Получение. Т. извлекается главным образом из монацитовых концентратов, в которых он содержится в виде фосфата. Промышленное значение имеют два способа вскрытия (разложения) таких концентратов:
1) обработка концентрированной серной кислотой при 200 °С (сульфатизация);
2) обработка растворами щёлочи при 140 °С. В сернокислые растворы продуктов сульфатизации переходят все редкоземельные элементы, Т. и фосфорная кислота. При доведении pH такого раствора до 1 осаждается фосфат Т.; осадок отделяют и растворяют в азотной кислоте, а затем нитрат Т. экстрагируют органическим растворителем, из которого Т. легко вымывается в виде комплексных соединений. При щелочном вскрытии концентратов в осадке остаются гидроокиси всех металлов, а в раствор переходит тринатрий фосфат. Осадок отделяют и растворяют в соляной кислоте; понижая pH этого раствора до 3,6-5, осаждают Т. в виде гидроокиси. Из выделенных и очищенных соединений Т. получают ThO2, ThCl4 и ThF4 - основные исходные вещества для производства металлического Т. металлотермическими методами или электролизом расплавленных солей. К металлотермическим методам относятся: восстановление ThO2 кальцием в присутствии CaCl2 в атмосфере аргона при 1100-1200 °С, восстановление ThCl4 магнием при 825-925 °С и восстановление ThF4 кальцием в присутствии ZnCl2 с получением сплава Т. и последующим отделением цинка нагреванием сплава в вакуумной печи при 1100 °С. Во всех случаях получают Т. в форме порошка или губки. Электролиз расплавленных солей ведётся из электролитов, содержащих ThCl4 и NaCI, или ванн, состоящих из смеси ThF4, NaCI, KCl. Т. выделяется на катоде в виде порошка, отделяемого затем от электролита обработкой водой или разбавленными щелочами. Для получения компактного Т. применяют метод порошковой металлургии (спекание заготовок ведут в вакууме при 1100-1350 °С) или плавку в индукционных вакуумных печах в тиглях из ZrO2 или BeO. Для получения Т. особо высокой чистоты используют метод термической диссоциации лодида Т.
Применение. Торированные катоды применяются в электронных лампах, а оксидно-ториевые - в магнетронах и мощных генераторных лампах. Добавка 0,8-1\% ThO2 к вольфраму стабилизирует структуру нитей ламп накаливания. ThO2 используют как огнеупорный материал, а также как элемент сопротивления в высокотемпературных печах. Т. и его соединения широко применяют в составе катализаторов в органическом синтезе, для легирования магниевых и др. сплавов, которые приобрели большое значение в реактивной авиации и ракетной технике. Металлический Т. используется в ториевых реакторах (См. Ториевый реактор).
При работе с Т. необходимо соблюдать правила радиационной безопасности (См. Радиационная безопасность).
А. Н. Зеликман.
Т. в организме. Т. постоянно присутствует в тканях растений и животных. Коэффициент накопления Т. (то есть отношение его концентрации в организме к концентрации в окружающей среде) в морском планктоне - 1250, в донных водорослях - 10, в мягких тканях беспозвоночных - 50-300, рыб - 100. В пресноводных моллюсках (Unio mancus) его концентрация колеблется от 3․10-7 до 1․10-5\%, в морских животных от 3․10-7 до 3․10-6\%. Т. поглощается главным образом печенью и селезёнкой, а также костным мозгом, лимфатическими железами и надпочечниками; плохо всасывается из желудочно-кишечного тракта. У человека суточное поступление Т. с продуктами питания и водой составляет 3 мкг; выводится из организма с мочой и калом (0,1 и 2,9 мкг соответственно). Т. - малотоксичен, однако как природный радиоактивный элемент вносит свой вклад в естественный фон облучения организмов (см. Фон радиоактивный).
Г. Г. Поликарпов.
Лит.: Торий, его сырьевые ресурсы, химия и технология, М., 1960; Зеликман А. Н., Металлургия редкоземельных металлов, тория и урана, М., 1961; Емельянов В. С., Евстюх и н А. И., Металлургия ядерного горючего, 2 изд., М., 1968; Сиборг Г. Т., Кац Дж., Химия актинидных элементов, пер. с англ., М., 1960; Bowen Н. J. М., Trace elements in biochemistry, L.-N. Y., 1966.
ТОРИЙ
я, мн. нет, м.
Химический радиоактивный элемент из сем. актиноидов, серовато-белый металл. Ториевый - из то-рия; относящийся к торию.
торий
ТОРИЙ, один из редких, химически открытых металлов, в ископаемом торит. Торина, ториновая окись, земля.
Изотопы тория
Торий-234; Торий-231; Торий-227; Торий-229
Изото́пы то́рия — разновидности химического элемента тория, имеющие разное количество нейтронов в ядре. На данный момент известны 30 изотопов тория и еще 3 возбуждённых изомерных состояния некоторых его нуклидов.
ТОР
СТРАНИЦА ЗНАЧЕНИЙ
Тор (значения)
I
а, м. геом.
Пространственная фигура, имеющая форму баранки или спасательного круга.
II
а, м., одуш., с прописной
В древнескандинавской мифологии: бог грома молнии, покровитель земледельцев.
Тор
СТРАНИЦА ЗНАЧЕНИЙ
Тор (значения)
I
один из главных богов скандинавской мифологии, бог грома, бури и плодородия (у древних германцев континента ему соответствовал Донар). Т. - главный защитник богов и людей от великанов и страшных чудовищ. Изображался рыжебородым богатырём, вооружённым боевым молотом.
II
(от лат. torus - вздутие, выпуклость, узел, валик)
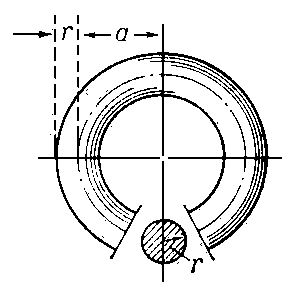
геометрическое тело, образуемое вращением круга вокруг прямой, лежащей в плоскости этого круга, но не пересекающей его (см. рис.). Приблизительно форму Т. имеет, например, баранка (или спасательный круг). Если радиус вращающегося круга равен r, а расстояние центра круга до оси вращения равно a, то поверхность Т. равна S = 4π2ar, а его объём V = 2π2ar2. Поверхность, ограничивающую Т., иногда также называют тором.
Рис. к ст. Тор.
III
торус, вал, один из классических греческих архитектурных обломов (См. Обломы). Т. строится по дугам окружности или более сложным кривым.
Тора
СОВОКУПНОСТЬ ИУДЕЙСКОГО ТРАДИЦИОННОГО ЗАКОНА
Иудейские законы; Моисеев закон; Письменная Тора; Яд (иудаизм); Таврат
Тора (евр. учение, закон) - у евреев так называются закон Моисея ипятикнижие, заключающие в себе этот закон. Сефер- Т. называютсяпергаментные свитки, написанные особыми писцами с величайшейтщательностью и содержащие в себе Пятикнижие Моисеево.
Википедия
Торий

То́рий (химический символ — Th, от лат. Thorium) — химический элемент 3-й группы (по устаревшей классификации — побочной подгруппы третьей группы, IIIB) седьмого периода периодической системы химических элементов Д. И. Менделеева, с атомным номером 90.
Относится к семейству актиноидов.
Простое вещество торий — тяжёлый слаборадиоактивный металл серебристого-белого цвета.


![[[Монацит]]-(Ce) [[Монацит]]-(Ce)](https://commons.wikimedia.org/wiki/Special:FilePath/Monazite-169954.jpg?width=200)


![[[Эвксенит]] [[Эвксенит]]](https://commons.wikimedia.org/wiki/Special:FilePath/Euxenite - Vegusdal, Norvegia 01.jpg?width=200)
-432814.jpg?width=200)

![синагоге]] синагоге]]](https://commons.wikimedia.org/wiki/Special:FilePath/Torah and jad.jpg?width=200)
